РегЛек 18-20 ноября 2019г. Приглашаем к участию
- Details
- Published: 18 October 2019
Уважаемые коллеги!
Высылаем Вам обновленную программу Научно – практической конференции «Современные подходы к экспертизе лекарственных средств» – РегЛек 2019", которая состоится c 18 ноября по 20 ноября 2019 года в гостинице «Холидей Инн Москва Сокольники»
ПРОГРАММА КОНФЕРЕНЦИИ
18 ноября
|
09.00-09.15 Открытие |
|||
|
09.15-11.15 Пленарное заседание Приглашены к участию: Алехин А.В.* – директор Департамента развития фармацевтической и медицинской промышленности Минпромторга России Олефир Ю.В. – генеральный директор ФГБУ «НЦЭСМП» Минздрава России Петров А.П.* – член Комитета по охране здоровья Государственной Думы Российской Федерации Романов Ф.А.* – директор Департамента государственного регулирования обращения лекарственных средств Минздрава России Шестаков В.Н. – директор ФБУ «ГИЛС и НП» Минпромторга России и др. |
|||
|
11.15-11.30 Перерыв |
|||
|
11.30-13.15 Основная программа |
|||
|
1.1. Практика применения правил и требований ЕАЭС при подаче электронного общего технического документа Модератор: Рычихина Е.М. – начальник контрольно-организационного Управления ФГБУ «НЦЭСМП» Минздрава России |
1.2. Безопасность лекарственных средств и фармаконадзор Модераторы: Глаголев С.В.* – заместитель начальника управления – начальник отдела организации фармаконадзора Управления организации государственного контроля качества медицинской продукции Росздравнадзора; Сеткина С.Б. – заместитель заведующего республиканской клинико-фармакологической лабораторией ЦЭ Республики Беларусь |
1.7. Современные подходы к оценке качества, эффективности и безопасности иммунобиологических лекарственных препаратов Модератор: Бондарев В.П. – директор Центра экспертизы и контроля МИБП ФГБУ «НЦЭСМП» Минздрава России |
|
|
13.15-14.00 Обед |
|||
|
14.00-15.45 Основная программа |
|||
|
1.3.Требования к регистрационному досье по качеству лекарственных средств Модератор: Ковалева Е.Л. – заместитель директора Центра экспертизы и контроля готовых лекарственных средств ФГБУ «НЦЭСМП» Минздрава России |
1.4. Информация о лекарственном препарате и ее регулирование в рамках Евразийского экономического союза Модератор: Рождественский Д.А. – начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Департамента технического регулирования и аккредитации Евразийской экономической комиссии |
||
|
15.45-16.15 Перерыв |
|||
|
16.15-17.45 Основная программа |
|||
|
1.5. Формирование модуля 2 регистрационного досье на лекарственный препарат: требования и подходы
|
1.6. Фармакопейное нормирование в процессе QbD Модератор: Волкова Р.А. – начальник лаборатории молекулярно-биологических и генетических методов испытаний Испытательного центра экспертизы качества МИБП ФГБУ «НЦЭСМП» Минздрава России |
||
|
Закрытие первого дня конференции *Докладчики на согласовании |
|||
19 ноября
|
10.00-12.00 Основная программа |
|
|
2.1. Вопросы формирования модулей регистрационного досье по доклиническим и клиническим исследованиям Модератор: Горячев Д.В. – директор Центра экспертизы и контроля готовых лекарственных средств ФГБУ «НЦЭСМП» Минздрава России |
2.2. Навигация по типам изменений регистрационного досье по правилам ЕАЭС Докладчик: Рождественский Д.А. – начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий Департамента технического регулирования и аккредитации Евразийской экономической комиссии |
|
12.00-13.00 Обед |
|
|
13.00-14.45 Основная программа |
|
|
2.3. Проблемные аспекты экспертизы качества лекарственных средств Модераторы: Лутцева А.И. – начальник Испытательного центра экспертизы качества лекарственных средств ФГБУ «НЦЭСМП» Минздрава России; Ваганова О.А. – начальник лаборатории биотехнологических препаратов Испытательного центра экспертизы качества лекарственных средств ФГБУ «НЦЭСМП» Минздрава России |
2.4. Планирование и проведение исследований биоэквивалентности – общий и продуктспецифичный подходы Модератор: Шохин И.Е. – генеральный директор ООО «Центр фармацевтической аналитики» |
|
14.45-15.15 Перерыв |
|
|
15.15-16.45 |
|
|
2.5. Первые результаты регистрации лекарственных средств в рамках ЕАЭС - Первый опыт регистрации лекарственных средств в рамках ЕАЭС в Республике Армения (Давтян К.Э. – координатор Минздрава Республики Армения по вопросам в сфере обращения лекарственных средств и медицинских изделий в рамках ЕАЭС) - Первый опыт регистрации лекарственных средств в рамках ЕАЭС в Республике Беларусь (Шамсутдинова Т.А. – начальник управления лекарственных средств РУП «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь) - Первый опыт регистрации лекарственных средств в рамках ЕАЭС в Российской Федерации (Меркулов В.А. – заместитель генерального директора по экспертизе лекарственных средств ФГБУ «НЦЭСМП» Минздрава России) - Первый опыт регистрации лекарственных средств в рамках ЕАЭС в Республике Казахстан (докладчик на согласовании) - Первый опыт регистрации лекарственных средств в рамках ЕАЭС в Кыргызской Республики (докладчик на согласовании) |
|
|
16.45-17.15 Перерыв |
|
|
17.15-18.15 Круглый стол Участвуют: Олефир Ю.В. – генеральный директор ФГБУ «НЦЭСМП» Минздрава России Меркулов В.А. – заместитель директора по экспертизе лекарственных средств ФГБУ «НЦЭСМП» Минздрава России Горячев Д.В. – директор Центра экспертизы и контроля готовых лекарственных средств ФГБУ «НЦЭСМП» Минздрава России Ковалева Е.Л. – заместитель директора Центра экспертизы и контроля готовых лекарственных средств ФГБУ «НЦЭСМП» Минздрава России Лутцева А.И. – начальник Испытательного центра экспертизы качества лекарственных средств ФГБУ «НЦЭСМП» Минздрава России Алексеева Е.О. – заместитель начальника контрольно-организационного Управления ФГБУ «НЦЭСМП» Минздрава России и др. |
|
|
Закрытие второго дня конференции *Докладчики на согласовании |
|
20 ноября
День качества лекарственных средств
|
10.00-10.30 Открытие |
|
|
10.30-12.30 |
|
|
3.1. Новый порядок ввода лекарственных средств в гражданский оборот Докладчики: Косенко В.В. – заместитель руководителя Росздравнадзора; Трапкова А.А. – врио начальника Управления организации государственного контроля качества медицинской продукции Росздравнадзора |
3.2. Перспективы развития контрольно-надзорной деятельности (регуляторная гильотина) Внедрение надлежащих практик в деятельность фармацевтических компаний Докладчик: Крупнова И.В. – начальник Управления лицензирования и контроля соблюдения обязательных требований Росздравнадзор |
|
12.30-13.30 Обед |
|
|
13.30-15.00 |
|
|
3.3. Пострегистрационный контроль качества лекарственных средств |
3.4. Секция на стадии формирования |
|
15.00-15.30 Перерыв |
|
|
15.30-17.00 |
|
|
3.5. Работа с рекламациями и жалобами на качество продукции Докладчики: Коростошевская Т.В. – старший специалист по качеству Представительства фирмы «Др. Редди`с Лабораторис Лтд.» (Индия)» и др. |
3.6. Валидация в процессах обращения лекарственных средств на пространстве Евразийского экономического союза |
Дополнительная информация
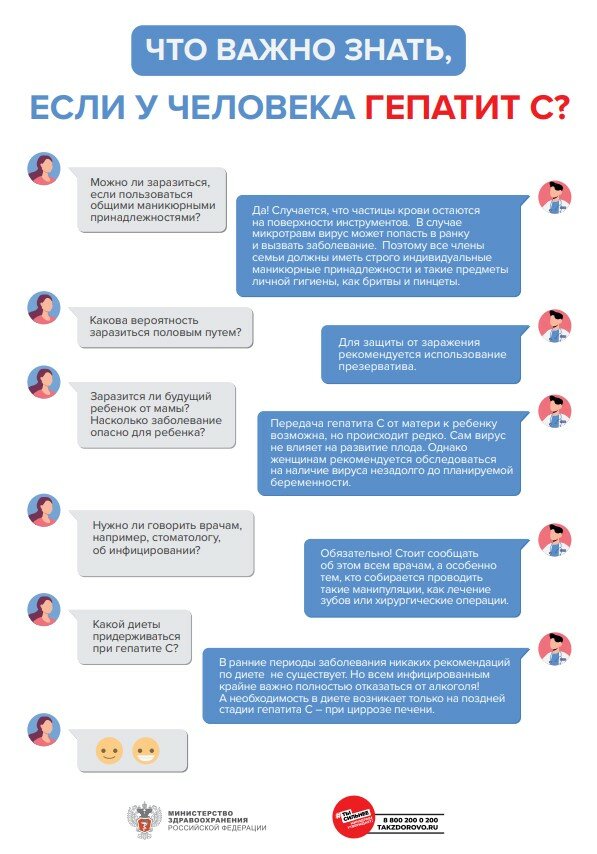











 .
.
 РегЛек 18-20 ноября 2019г. Приглашаем к участию
РегЛек 18-20 ноября 2019г. Приглашаем к участию